افزایش روزافزون انتشار CO 2 انسانی ما را ملزم به توسعه فن آوری های جذب، استفاده و ذخیره کربن (CCUS) کرده است و به منظور رسیدگی به تغییرات آب و هوا، این گزینه ها باید در مقیاس باشند. علاوه بر سیستم های مهندسی شده CO2 جذب نیروگاه ها و فرآیندهای شیمیایی، رویکردهای نوظهوری وجود دارد که شامل زمین (به عنوان مثال، هوا، زمین و اقیانوس) در محدوده سیستم آن می شود. از آنجایی که اقیانوس ها بزرگترین مخزن طبیعی CO 2 را تشکیل می دهند ، فناوری هایی که می توانند ذخیره کربن در اقیانوس ها را افزایش دهند بسیار مورد نیاز هستند. با الهام از بیولوژیکی صحبت میکنیم در اینجا، ما در مورد افزایش قلیایی و واکنشهای هیدراتاسیون CO 2 که میتواند تعادل آب اقیانوس را برای پمپ کردن کربن بیشتر به این سینک طبیعی تغییر دهد. علاوه بر این، ما کارهای اخیر را برجسته میکنیم که میتوانند CO2 جذب شده توسط اقیانوس را به مواد شیمیایی، سوخت و مواد با استفاده از انرژیهای تجدیدپذیر مانند باد دور از ساحل برداشت و تبدیل کنند . از طریق این فناوریهای نوظهور و نوآورانه، کربن آلی و معدنی حاصل از راهحلهای مبتنی بر اقیانوس میتواند جایگزین کربن مشتقشده از فسیل شده و اقتصاد کربن جدیدی ایجاد کند. توسعه این فناوریهای CCUS مبتنی بر اقیانوس بدون عواقب ناخواسته زیستمحیطی یا زیستمحیطی، که چرخه کربن مهندسیشده جدیدی را ایجاد میکند که با سیستم زمین هماهنگ است، حیاتی است.
معرفی
انتشار روزافزون کربن جهانی انسان زایی 40 GtCO 2 y -1 را در سال 2020 به خود اختصاص داده است ( Friedlingstein et al., 2020 ) و بنابراین مدیریت موثر کربن از طریق سیستم های طبیعی و مهندسی شده برای رسیدگی به تغییرات آب و هوا بسیار مهم است ( Caldeira et al., 2018). ؛ واتسون و همکاران، 2020 ؛ آکادمی های ملی، 2019 ؛ آکادمی های ملی، 2022 ؛ کلمن و همکاران، 2020 ). در چند دهه گذشته، تلاش قابل توجهی برای جذب CO2 از منابع نقطه ای صنعتی مانند نیروگاه های زغال سنگ و گاز طبیعی انجام شده است . در حالی که جهان به سمت کربن زدایی سریع بخشهای صنعتی حرکت میکند، فناوریهای انتشار منفی (NETs) مسیر مهمی را برای جذب CO2 منتشر شده در تاریخ فراهم میکنند . به عنوان مثال، فناوری هایی که می توانند مستقیماً CO 2 را از جو جذب کنند، به نام جذب مستقیم هوا (DAC)، در حال حاضر در حال توسعه هستند ( Sanz-Perez et al., 2016 ). DAC به دلیل غلظت بسیار کم CO 2 در هوا چالش برانگیز است (یعنی ~420 ppm در هوا ( Tans and Keeling, 2021 ) در مقایسه با 3-15٪ در گازهای دودکش نیروگاه ها. سنگل زاده و همکاران، 2014 )) و نیازمند الزامات منحصر به فردی مانند افت فشار کم و پایداری حرارتی اکسیداتیو بالا است. پیشرفت های قابل توجهی در طراحی و افزایش مقیاس کنتاکتورهای هوا صورت گرفته است و در حال حاضر تلاش ها بر روی توسعه مواد DAC کارآمدتر و انتخابی تر و روش های بازسازی متمرکز شده است. ( سانز پرز و همکاران، 2016 ). CO 2 گرفته شده از جو با DAC را می توان “کربن غیر فسیلی” در نظر گرفت و می تواند برای تولید مواد شیمیایی، مواد و سوخت با استفاده از انرژی های تجدید پذیر استفاده شود. بنابراین، DAC وعده داده است که نه تنها مسیری به سوی فناوری انتشار منفی ارائه میکند، بلکه یک اقتصاد کربن جدید ایجاد میکند که مبتنی بر منابع فسیلی نیست.
منتشر شده تاریخی CO 2 را می توان در سه مکان در محیط یافت – هوا ( حدود گازی 420 پی پی ام CO 2 )، زمین (به عنوان مثال، کربنات های معدنی و CO2 در خاک)، و در اقیانوس. منبعی شگفت آور از کربن را می توان در اقیانوس های زمین یافت. اقیانوس بزرگترین مخزن طبیعی CO 2 است و تصور می شود حداقل 2.5 PgC سال -1 کربن انسانی را از سال 1994 تا 2007 جذب کرده است ( واتسون و همکاران، 2020 ). در سال 2019، بودجه جهانی کربن دریافت که اقیانوس ها 2.6 GtC y -1 را جذب کردند ( Friedlingstein et al., 2020 ). در اقیانوس ها، بیشتر CO 2 ساخته شده توسط انسان در اعماق کم (کمتر از 1000 متر) یافت می شود ( کالدیرا و همکاران، 2018 )، و با افزایش مداوم غلظت CO2 در جو، pH اقیانوس کم عمق به طور قابل توجهی پایین تر است. نسبت به سطوح عمیق که منجر به اسیدی شدن اقیانوس می شود ( DeVries et al., 2017 ; Caldeira et al., 2018 ). نکته مهم، غلظت کربن معدنی در اقیانوس ها (0.099 کیلوگرم CO 2 m 3 ) 125 برابر بیشتر از غلظت CO 2 در هوا است ( خاتیوالا و همکاران، 2013 ؛ Sanz-Perez و همکاران، 2016). ; پترسون و همکاران، 2019 ، که نشان می دهد جذب مستقیم اقیانوس (DOC) CO 2 در اقیانوس یا آب دریا که با آبزیان دریایی تداخلی ندارد ( Eisaman et al., 2018 ; Fuss et al., 2018 ) مهم دیگری است. مسیری برای فناوری های جذب کربن ( شریفیان و همکاران، 2021 ؛ ترلوو و همکاران، 2021 ). نشان داده شده است، کربن جذب شده توسط اقیانوس به اشکال مختلف از جمله کربن معدنی محلول و زیست توده دریایی تبدیل می شود همانطور که در شکل 1 .
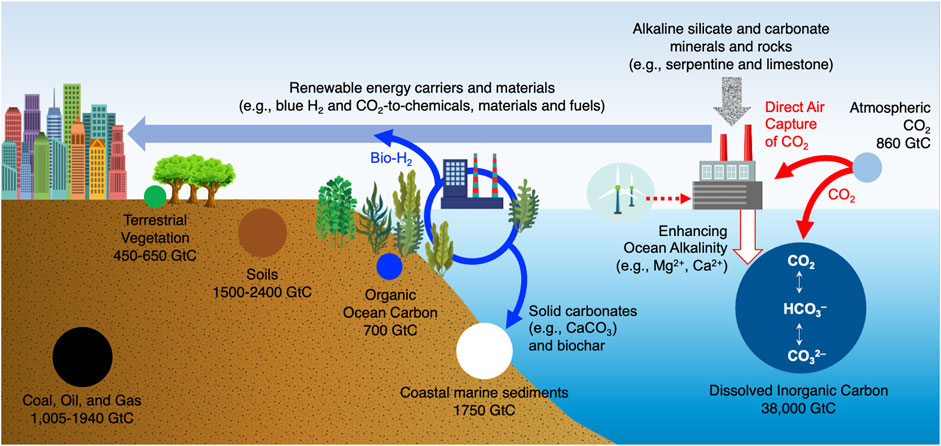 شکل 1 . توزیع کربن بر روی زمین (داده های استفاده شده از بودجه جهانی کربن، 2020 (1)).
شکل 1 . توزیع کربن بر روی زمین (داده های استفاده شده از بودجه جهانی کربن، 2020 (1)).
یا دریا عمدتاً از اسید کربنیک (H2CO3 ، ) در آب اقیانوس بی کربنات (HCO3- شده است . ) و کربنات (CO32- ) کربن محلول تشکیل انحلال دی اکسید کربن در آب اقیانوس توسط فشار جزئی دی اکسید کربن در جو و pH و قلیایی بودن آب کنترل می شود. پس از حل شدن در آب اقیانوس، دی اکسید کربن با بی کربنات (pKa = 5.9) (Mojica Prieto and Millero, 2002) و کربنات (pKa = 9.1) در تعادل است ( Mojica Prieto and Millero , 2002 ) به دنبال معادلات. 1-3 _ _
بنابراین، در pH سطح اقیانوسی معمولی 8.2، بیشتر کربن محلول به صورت HCO 3- ، و نه دی اکسید کربن محلول در نظر گرفته می شود . این به وضوح در شکل 2 مشاهده می شود که زایی CO 2 در آب دریا را در مقادیر مختلف pH نشان می دهد. در حالی که HCO 3- داد گونه کربن غالب در pH آب اقیانوس است، . اگر pH کاهش یابد می توان CO2 را تکامل برای تعیین میزان تفکیک کربنات می توان قلیائیت کل آب اقیانوس را اندازه گیری کرد. قلیائیت کل ( A T ) به عنوان کمبود پروتون در یک محلول نسبت به خط پایه تعریف می شود. با افزایش قلیائیت آب اقیانوس ها، تجزیه بیشتر کربنیک اسید و بی کربنات اتفاق می افتد و کربنات بیشتری تولید می شود. بنابراین، افزودن قلیائیت به اقیانوس، جذب کل CO2 توسط اقیانوس را افزایش می دهد .
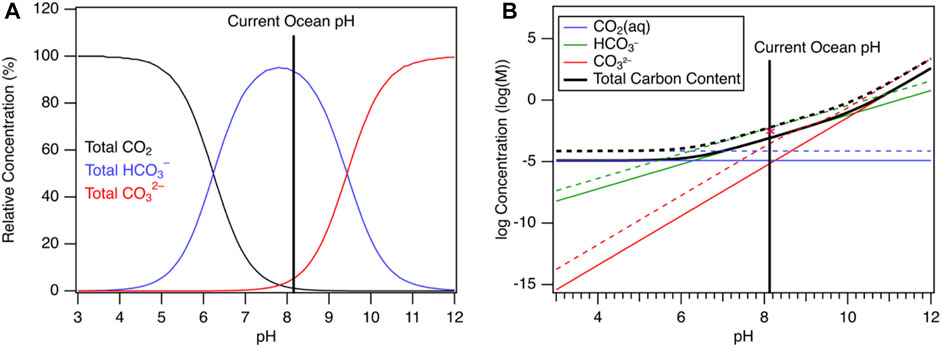 شکل 2 . (الف) نمودار Bjerrum که زایی کربن معدنی محلول را در پسزمینه آب دریا نشان میدهد ( Riebesell et al., 2010 ) در غلظت کل کربن ثابت در 25 درجه سانتیگراد (B) CO2 زایی در مقابل pH برای خالص (خطوط جامد) و آب دریا. ( Riebesell et al., 2010 ) (خطوط نقطه چین) در فشار جزئی ثابت در یک سیستم CO 2 باز در دمای 25 درجه سانتیگراد. محاسبات با ChemEQL انجام شد ( Müller, 2015 ). ستاره نشان دهنده محتوای کربن کل آب است که در Ref. ( ریبسل و همکاران، 2010 ).
شکل 2 . (الف) نمودار Bjerrum که زایی کربن معدنی محلول را در پسزمینه آب دریا نشان میدهد ( Riebesell et al., 2010 ) در غلظت کل کربن ثابت در 25 درجه سانتیگراد (B) CO2 زایی در مقابل pH برای خالص (خطوط جامد) و آب دریا. ( Riebesell et al., 2010 ) (خطوط نقطه چین) در فشار جزئی ثابت در یک سیستم CO 2 باز در دمای 25 درجه سانتیگراد. محاسبات با ChemEQL انجام شد ( Müller, 2015 ). ستاره نشان دهنده محتوای کربن کل آب است که در Ref. ( ریبسل و همکاران، 2010 ).
همانطور که در شکل 1 نشان داده شده است، کربن موجود در اقیانوس می تواند توسط آبزیان مانند زیست توده دریایی، مرجان ها و صدف ها نیز مورد استفاده قرار گیرد. به دلیل تغییرات آب و هوایی، زیست دریایی به سرعت در حال تغییر است و سلامت آبزیان در معرض تهدید قرار می گیرد. بنابراین، جذب مستقیم اقیانوس (DOC) و استفاده از زیست توده دریایی برای تولید انرژی و مواد به عنوان راهحلهای مهندسی منحصربهفرد برای کاهش تغییرات آب و هوا ظاهر شدهاند، زیرا تعادل کربن پایداری را در اقیانوس فراهم میکنند که برای پایداری زمین مهم است. در اینجا، ما در مورد چگونگی ذخیره، جذب، و تبدیل CO2 اقیانوسها و چگونگی توسعه فناوریهای مبتنی بر اقیانوس برای برداشت کربن غیرفسیلی از اقیانوس برای ایجاد اقتصاد کربن جدید بحث میکنیم .
ذخیره کربن در اقیانوس
همانطور که بحث شد، اقیانوس بزرگترین مخزن طبیعی کربن است. تسریع و افزایش میدهند ، از جمله قلیائیت افزوده و کاتالیز آنزیمی. در زیر، ما چندین راه را پیشنهاد میکنیم که جذب CO2 توسط اقیانوس را
افزایش جذب کربن در اقیانوس از طریق افزایش قلیاییت
اقیانوس می تواند CO2 را به عنوان کربنات در مقیاس های زمانی زمین شناسی جذب و ذخیره کند . انسانی متأسفانه، نرخ انتشار CO 2 برای اقیانوس ها بسیار سریع است و بنابراین، عدم تعادل کربن منجر به اسیدی شدن اقیانوس ها می شود. به منظور بازگرداندن تعادل pH اقیانوس و ذخیره کربن بیشتر در اقیانوس، چندین روش در نظر گرفته شده است. این فناوریها متکی به آنتالپیهای تشکیل افزودن یونهای فلزی آبی مانند Ca2 + و Mg2 + به بیکربنات و آب اقیانوس غنی از کربنات هستند ( رنفورث و هندرسون، 2017 ). اقیانوس در حال حاضر حاوی 0.010 مول کیلوگرم – 1 Ca 2 + و 0.052 مول کیلوگرم – 1 Mg 2 + است ، اما ظرفیت آن برای قلیائیت اضافی بسیار زیاد است ( Riebesell et al., 2010 ). یافت. منبع اضافی فلزات قلیایی را می توان در کانی ها و سنگ های فراوان زمین مانند سنگ آهک (CaCO 3 )، سنگ های اولترامافیک (به عنوان مثال، الیوین ((Mg,Fe) 2 SiO 4 ) و سرپانتین (Mg 3 Si 2 O 5 ) (OH) 4 )). اینها را می توان استخراج، پردازش و حل کرد تا Ca2 + و Mg2 + بدست آورد ( رنفورث و همکاران، 2013 ؛ لا پلانت و همکاران، 2021). و افزودن آنها به آب اقیانوس منجر به جذب و تبدیل متعاقب آن CO 2 اتمسفر به بی کربنات (گونه های کربن غالب در pH 8.2) و یون های کربنات می شود.
نمونه اولیه این فناوری از CaO و Ca(OH) 2 استفاده می کند که به راحتی حل می شوند و غلظت بی کربنات را در آب اقیانوس افزایش می دهند ( خشگی، 1995 ). بیشتر CaO و Ca(OH) 2 ) تولید می شوند در حال حاضر از سنگ آهک فراوان زمین (CaCO 3 ( Kenny and Oates, 2007 ; Kantzas et al., 2022 ) اما می توانند از ضایعات قلیایی صنعتی مانند باطله معدن، ضایعات نیز استخراج شوند. خاکستر به انرژی، سرباره آهن و فولاد و بتن ضایعاتی ( رنفورث، 2019 ؛ بی ویت و همکاران، 2020 ؛ گادیکوتا، 2021 ؛ هونگ و همکاران، 2021 ؛ ریم و همکاران، 2021 ). از آنجایی که سنگ آهک در حال حاضر حاوی یک کربن در هر کلسیم است، حداکثر تنها 1 مول CO 2 جذب کرد اضافی را می توان با تولید محلول های بی کربنات از CaCO 3 . از سوی دیگر، اگر مواد معدنی سیلیکات حاوی کلسیم و منیزیم مانند الیوین، ( Gadikota و همکاران، 2014 )، سرپانتین، ( پارک و همکاران، 2008 )، ولاستونیت، ( ژائو و همکاران، 2013 )، پیروکسن ها، و فلدسپات پلاژیوکلاز استفاده می شود، ظرفیت جذب و ذخیره CO2 این واکنش از نظر تئوری می تواند دو برابر شود، زیرا آن فلزات قلیایی بدون هیچ کربن متصل استخراج می شوند. در واقع، CO ظرفیت جذب این مواد معدنی سیلیکات دار کمی کمتر از دو خواهد بود زیرا نسبت کلسیم یا منیزیم به CO 2 به منبع قلیاییت و pH آب اقیانوس بستگی دارد. اگر یون های منیزیم و کلسیم به اقیانوس اضافه شوند، تعادل کلی نشان داده شده در شکل 2 تغییر می کند و CO2 اضافی از هوا به اقیانوس جذب می شود. واکنش های نمونه ای از مواد معدنی حاوی کلسیم در زیر آورده شده است ( 4-8 ) معادل .
از مواد معدنی کربناته:
از مواد معدنی سیلیکات بدون فاز کربناته:
مواد معدنی حاوی منیزیم با جذب و ذخیره CO 2 تحت واکنش های مشابهی قرار می گیرند . یک چالش این است که مواد معدنی سیلیکات به طور کلی واکنش کمتری نسبت به مواد معدنی کربناته در آب اقیانوس دارند و بنابراین، این فرآیند اغلب از نظر جنبشی محدود است. سایر کارهای اخیر نشان داده است که ضایعات صنعتی مانند خاکستر بادی، سرباره فولاد و گرد و غبار سیمان نیز می توانند برای افزایش قلیایی بودن اقیانوس ها استفاده شوند ( Gadikota et al., 2020 ).
در تمام این واکنش ها، فرآیند محدود کننده سرعت انحلال معدنی تصور می شود. انحلال مواد معدنی خارج از محل می تواند به طور قابل توجهی شسته شدن Ca 2 + و Mg 2 + از منابع مختلف (در مقیاس زمانی چند ساعت یا کمتر) را تسریع کند ( Gerdemann et al., 2007 ; Gadikota et al., 2014 ). محلولهای قلیایی غنی از کلسیم و منیزیم را میتوان در مکانهای مورد نظر به اقیانوس اضافه کرد، اگرچه این فناوری خارج از محل به ساخت سیستمها و زیرساختهای راکتور مهندسی شده نیاز دارد. در فرآیندهای انحلال مواد معدنی اغلب از مواد شیمیایی از جمله اسیدها و لیگاندها برای تسریع فرآیند شستشوی کلسیم و منیزیم استفاده می شود. چند فن آوری در حال ظهور پیشنهاد شده است، از جمله تولید اسید (به عنوان مثال، HCl) از آب اقیانوس از طریق الکترولیز با استفاده از انرژی های تجدید پذیر ( House et al., 2007 ). اسید قوی تولید شده می تواند مواد معدنی را به سرعت حل کند تا به اقیانوس اضافه شود ( راو، 2008 ؛ راو و همکاران، 2013 ). استفاده از این اسید “تجدید پذیر” در محلول های مبتنی بر اقیانوس نیز در بخش بعدی در مورد بازیابی الکتروشیمیایی CO مورد بحث قرار خواهد گرفت. 2 از اقیانوس.
. انحلال مواد معدنی درجا از سطح اقیانوس برای انجام انحلال مواد معدنی استفاده می کند و اغلب از نظر نرخ انحلال مواد معدنی محدود است زیرا دمای اختلاط و واکنش به شرایط محیطی محدود می شود و نمی توان از افزودنی های شیمیایی استفاده کرد بنابراین، انتخاب رویکرد مناسب برای مناطق مختلف و ترکیبات معدنی متنوع (یعنی درجا در مقابل خارج ) مهم است. پروژه CarbFix در ایسلند نشان داده است که فلزات قلیایی می توانند به طور موثر در آب اشباع شده با CO 2 آزاد شوند و در نهایت کربنات های جامد تشکیل دهند ( Snæbjörnsdóttir et al., 2020 ). رویکرد مشابهی را می توان برای تنظیم قلیایی بودن اقیانوس استفاده کرد. CarbFix2 در حال بررسی این رویکرد با استفاده از CO2 گرفته شده از تصفیه خانه های آب برای کانی سازی با استفاده از آب دریا است ( Snæbjörnsdóttir و همکاران، 2020 ؛ Carbfix، 2022 ). یک رویکرد مکمل، sCS 2 (تک مرحله ترسیب کربن و ذخیره سازی)، که شامل رسوب الکترولیتی کربنات ها از CO 2 و آب دریا است، همچنین ممکن است راه حل های جالبی بر پایه اقیانوس ارائه دهد. لا پلانت و همکاران، 2021 ). پروژه قابل توجه دیگر از برنامه CarbonSAFE در ایالات متحده است که هدف آن تزریق CO 2 به بازالت اقیانوس در حوضه Cascaida ( گلدبرگ و همکاران، 2018 ) است.
یکی از چالشهای مهم برای فناوریهای افزودن قلیایی، تحویل کارآمد انرژی مقادیر زیادی از مواد قلیایی (مانند CaO، Ca(OH) 2 ، Ca-سیلیکاتها، و غیره) به آب اسیدی اقیانوس است. ما معتقدیم که فناوریهای جدید و نوآورانه فراساحلی و سیستمهای حملونقل موجود میتوانند برخی از مسائل اساسی در جداسازی CO2 مبتنی بر اقیانوس را برطرف کنند . به عنوان مثال، خطوط کشتیرانی ( Hassellöv et al., 2013 ) سهم عمده ای در اسیدی شدن اقیانوس دارند، و بنابراین، پیشنهاد شده است که یکی از روش های مبارزه با اسیدی شدن موضعی، حمل مواد معدنی و کربنات ها بر روی تانکرها به نقاط مختلف اقیانوس است (Butenschön ) و همکاران، 2021 ؛ Caserini و همکاران، 2021 ). برای این استفاده، کنترل میزان افزودن قلیایی به آب اقیانوس بسیار مهم است تا اطمینان حاصل شود که تغییرات محلی در pH و قلیاییت تأثیر مضری بر اکوسیستمهای محلی نخواهد داشت. تغییرات محلی برای روشهای کربناتهسازی درجا احتمالاً بر شیمی کربنات آب دریا نیز تأثیر میگذارد، که میتواند پیامدهای مهم و/یا ناشناختهای برای کلسیفایرها داشته باشد.
یکی دیگر از مشکلات بالقوه افزودن مواد معدنی به آب اقیانوس، افزایش غلظت محلی گونه های ناخواسته محلول است. این برای ضایعات قلیایی صنعتی حاوی نیکل (باطله معدن سرپانتین)، آهن و سریم (سرباره آهن و فولاد)، و طیف وسیعی از فلزات سنگین مانند روی، آهن و سرب (خاکستر گیاهان تبدیل به زباله به انرژی) حیاتی است. این یون های فلزی می توانند اثرات ناخواسته و بالقوه سمی بر زندگی موجود در آب اقیانوس داشته باشند ( هارتمن و همکاران، 2013 ؛ مونتسرات و همکاران، 2017 ؛ فوس و همکاران، 2018 ). به عنوان مثال، غلظت های پایین نیکل (حدود 0.3 میکرومولار) به عنوان سمیت سلولی برای Mytilus edulis (صدف آبی) شناخته شده است ( مونتسرات و همکاران، 2017 ). بنابراین، هر گونه ناخالصی مضر برای محیط زیست و اکوسیستم باید از این مواد زائد قبل از اضافه شدن به آب اقیانوس حذف شود. یک رویکرد خارج از محل که ابتدا مواد نسبتاً خالص حاوی کلسیم و منیزیم را که از سیلیکاتها یا زبالههای صنعتی قلیایی به دست میآیند تولید میکند، دوستی زیستمحیطی فناوری افزودن قلیایی پیشنهادی را تا حد زیادی بهبود میبخشد. علاوه بر این، رویکرد ex-situ با جدا کردن ناخالصیها و مواد غیر قلیایی از مواد اولیه، جرم مواد قلیایی را که باید به مکانهای اقیانوسی مختلف تحویل داده شود، به حداقل میرساند.
فن آوری های الهام گرفته شده از بیولوژیکی با استفاده از کربنیک انیدراز
کربنیک انیدرازها یک خانواده متالوآنزیم هستند که از نظر بیولوژیکی هیدراتاسیون و کم آبی CO 2 را کاتالیز می کنند . آنها در تمام پستانداران، گیاهان، جلبک ها، قارچ ها و باکتری ها یافت می شوند ( Elleuche and Poggeler, 2009 ). ، نقش کلیدی در تعادل کربن اقیانوس دارند انیدرازهای کربنیک با سرعت بخشیدن به مراحل محدودکننده سرعت جذب اقیانوس CO2 . آنها همچنین در هموستاز CO 2 ، واکنشهای بیوسنتزی، لیپوژنز، اورهزایی، و کلسیفیکاسیون، در میان سایر فرآیندهای مرتبط با زندگی در اقیانوس نقش دارند ( Supuran, 2016 ). در طبیعت، کربنیک انیدرازها در پنج کلاس مختلف ɑ، β، ɣ، δ و ζ یافت می شوند. محل فعال انیدرازهای کربنیک حاوی یک گروه مصنوعی یونی فلزی چهار وجهی (II) است که با سه زنجیره جانبی هیستیدین و یک مولکول آب هماهنگ شده است. این امکان دسترسی به یک گونه فعال هیدروکسید فلزی را فراهم می کند که می تواند CO 2 را متصل کرده و یک مجتمع بی کربنات فلزی تولید کند. در بیشتر کربنیک انیدرازها، روی 2+ یون فلزی فعال کاتالیزوری است، اگرچه Fe 2+ و Cd2 + تصور میشود که برای برخی از کربنیک انیدرازها مرکزی هستند. شرکت 2+ همچنین مشاهده شده است که با کاهش فعالیت کمی جایگزین روی 2+ می شود . تصور می شود که انیدرازهای کربنیک واسطه هیدراتاسیون CO 2 از طریق مکانیسم پیشنهادی در شکل 3 هستند که با Zn 2 + مرکز فلز نشان داده شده است. در اینجا، یک کمپلکس چهار وجهی Zn 2+ aquo deprotonated میشود و یک سایت فعال هیدروکسید روی بسیار هستهدوست را تشکیل میدهد. انتشار CO 2 در محل فعال و حمله هسته دوست به CO 2 باعث تولید بی کربنات روی 2 + می شود . جابجایی بیشتر بی کربنات با آب امکان تکمیل چرخه کاتالیزوری آنزیمی را فراهم می کند.
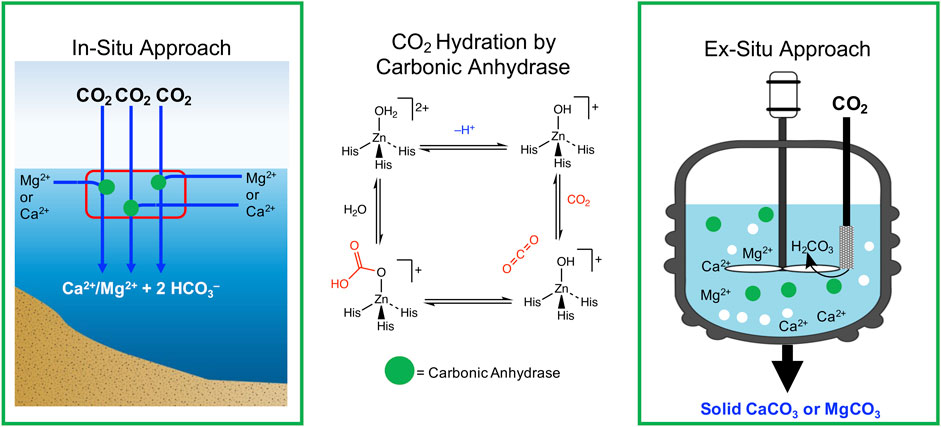 شکل 3 . تصویری از چگونگی استفاده از کربنیک انیدراز برای افزایش قلیاییت در هر دو روش درجا و خارج . پانل میانی شکل مکانیسم پیشنهادی برای هیدراتاسیون CO 2 (His = هیستیدین) را توضیح می دهد.
شکل 3 . تصویری از چگونگی استفاده از کربنیک انیدراز برای افزایش قلیاییت در هر دو روش درجا و خارج . پانل میانی شکل مکانیسم پیشنهادی برای هیدراتاسیون CO 2 (His = هیستیدین) را توضیح می دهد.
بهبود سرعت که برای فناوریهای CDR/NET، کربنیک انیدراز مفید است زیرا با کاتالیز کردن سرعت هیدراتاسیون CO2 جذب CO 2 اغلب مرحله محدودکننده سرعت در این واکنشها است، به کمک میکند. واکنش همچنین می تواند در جهت معکوس عمل کند. بنابراین، چندین گروه نشان دادهاند که کربنیک انیدراز میتواند انحلال کلسیتها در آب دریا را کاتالیز کند تا میزان قلیائیت افزودن به اقیانوس را افزایش دهد (لیو و همکاران، 2005 ؛ لی و همکاران، 2009 ؛ زی و وو، 2013 ؛ سوبهاس و همکاران. al., 2017 ). در این سیستم ها، CO 2 به محلولی حاوی آنزیم کربنیک انیدراز و ذرات کلسیت تبدیل می شود. کربنیک انیدراز به سرعت CO 2 محلول را با آن در فاز گاز (یعنی اتمسفر) متعادل می کند، و در نتیجه یک سیستم واکنشی ایجاد می شود که توسط سینتیک تبادل گاز محدود می شود. انحلال سریع CO 2 توسط کربنیک انیدراز پروتون های اضافی برای انحلال کلسیت فراهم می کند. بنابراین، بارش کلسیت ممکن است به حداقل برسد زیرا کربنیک انیدراز واکنش هیدراتاسیون CO 2 را کاتالیز می کند . یکی از چالشهای مرتبط با کربنیک انیدراز طبیعی، پایداری حرارتی و طولانیمدت آن است، و بنابراین تلاشهایی برای محصور کردن و بیحرکت کردن کربنیک انیدراز و گنجاندن آن در طرحهای راکتور نوآورانه مانند راکتور یکپارچه و راکتور بستر سیال وجود دارد. پاتل و همکاران، 2013 ; پاتل و همکاران، 2014a ; پاتل و همکاران، 2014b ; بوسیف و همکاران، 2020 ؛ Fabbricino و همکاران، 2021 ; ورما و همکاران، 2021 ).
یکی دیگر از حوزه های تحقیقاتی نوظهور، کاتالیز الهام گرفته شده از بیولوژیک با تقلید از کربنیک انیدراز است. شیمی مولکولهای کوچک برای سنتز کاتالیزورهای فلزی همگن با پایداری حرارتی قابلتوجهی بهبود یافته در مقایسه با کربنیک انیدراز طبیعی، که میتواند تحت شرایط مورد نیاز برای CO 2 جذب و واجذب از نظر حرارتی دناتوره شود، مورد بررسی قرار گرفته است ( Koziol et al., 2012 ). مرکز هماهنگی Zn 2+ در سایت فعال کربنیک انیدراز توسط چندین گروه با استفاده از سیستم های لیگاند آمین و تریس (پیرازولیل بورات) مختلف مدل سازی شده است ( کیمورا و همکاران، 1990 ؛ لونی و همکاران، 1993 ؛ شرودت و همکاران، 1997). ؛ خان و همکاران، 2012 ؛ کوزیول و همکاران، 2012 ؛ فلوید و همکاران، 2013 ؛ لیو و همکاران، 2013 ؛ ورما و همکاران، 2021 ). در اصل، تصور می شود که این سیستم ها نشان داده شده است، با CO 2 با استفاده از مکانیسم مشابهی که در شکل 3 واکنش نشان می دهند . استفاده شدهاند انواع دیگر کمپلکسهای تک، دو هستهای و سههستهای، از جمله مولکولهای دارای مراکز مس یا نیکل، نیز برای جذب CO2 ( ورما و همکاران، 2021 )، ( برناوئر و همکاران، 2002). ; کلکس و همکاران، 2002 ; Appel et al., 2005 ; Verdejo و همکاران، 2008 ; ماتئوس و همکاران، 2011 ). یکی از بهترین کاتالیزورهای مورد مطالعه در این زمینه، 1،4،7،10-تتراآزاسیکلودودکان Zn(II) (چرخه روی) است که به دلیل وزن مولکولی کم، فقط 5 برابر فعالیت کمتری نسبت به کربنیک انیدراز طبیعی نشان می دهد. ( کوزیول و همکاران، 2012 ). چرخه روی در دماهای مربوط به صنعت تا 75 درجه سانتیگراد فعال باقی می ماند ( Koziol et al., 2012 ).
برداشت کربن غیر آلی و آلی جذب و ذخیره شده در اقیانوس
به منظور دستیابی به کربن زدایی عمیق و رسیدگی به تغییرات آب و هوایی، ما باید از فناوری های انتشار صفر فراتر برویم و مجموعه ای چند وجهی از NET ها (تکنولوژی های انتشار منفی) را توسعه دهیم. علاوه بر این، ما نیاز به ایجاد یک اقتصاد کربن جدید داریم که مبتنی بر کربن فسیلی نباشد و از نزدیک با اقتصاد هیدروژنی جدید ادغام شود. مکان و مقیاس انواع مختلف کربن در شکل 1 نشان داده شده است . با استقرار سریع انرژی های تجدیدپذیر از جمله باد در ساحل و کاهش قابل توجه هزینه آن، ما اکنون پتانسیل زیادی برای برداشت کربن معدنی اقیانوس و تبدیل آن به مواد شیمیایی، مواد و سوخت با ارزش بالا داریم. بازیابی مستقیم کربن از آب اقیانوس ها را می توان از طریق مسیرهای شیمیایی و بیولوژیکی مختلف به دست آورد. تعدادی از مطالعات جالب وجود دارد که بر روی کشت و برداشت زیست توده دریایی تمرکز دارند. زیست توده دریایی برای تولید انرژی و مواد شیمیایی جذاب است زیرا از سطح بزرگ اقیانوس استفاده می کند و نیازی به استفاده از زمین ندارد.
برگردد (نگاه کنید به برای تبدیل و استفاده از کربن معدنی ذخیره شده در اقیانوس، یک رویکرد تغییر تعادل، که در آن اسید مستقیماً به آب غنی از کربنات اضافه می شود تا تعادل آن به CO 2 معادلات 1-3 ، . شکل 2 )، اغلب وجود دارد استفاده شده. یک سلول اسیدی الکتروشیمیایی از یک غشای تبادل یونی با ولتاژ اعمال شده برای مبادله یون های سدیم با پروتون استفاده می کند ( Willauer et al., 2011 ). استفاده کرد. در نتیجه، اسید (مثلاً HCl) و باز (مثلاً NaOH) را میتوان با استفاده از برق تجدیدپذیر تولید کرد و میتوان از آنها برای جذب یا انتشار CO2 از اقیانوس با تغییر تعادل در این سیستمها، گاز هیدروژن نیز به عنوان یک محصول جانبی تکامل مییابد، و بنابراین، اقتصاد کربن و هیدروژن میتواند به طور موثری یکپارچه شود.
جذب پشت سر هم و تبدیل کربن اقیانوس به مواد شیمیایی، سوخت و مواد
تعدادی از سیستم های الکتروشیمیایی نوآورانه برای جذب و تبدیل CO2 ذخیره شده در اقیانوس به کار گرفته شده اند . همانطور که بی کربنات ها و کربنات ها از طریق جابجایی تعادل الکتروشیمیایی به CO 2 تبدیل می شوند ، به محصولات کربن با وزن مولکولی کم (C1 یا C2 ) تبدیل می شوند. برای مثال، دیگدایا و همکاران. اخیراً یک رویکرد نوآورانه برای جذب و تبدیل کربن محلول در اقیانوس به CO با بازده کل فارادائیک تا 95٪ گزارش شده است ( Digdaya et al., 2020 ). دستگاه آنها با استفاده از یک سلول الکترودیالیز غشایی دوقطبی کار می کند. در آنجا، انتقال یون از طریق غشاها یک گرادیان پروتون ایجاد می کند (همانطور که در بالا توضیح داده شد)، آب اقیانوس را اسیدی می کند و CO 2 را آزاد می کند . محلول CO 2 سپس با استفاده از الکترودهای Ag یا Cu کاهش می یابد. سیستم کاتالیزور نقره برای تولید CO بسیار انتخابی بود. نمونه های دیگر از این نوع سیستم های الکتروشیمیایی از غشاهای دوقطبی برای تسهیل تبدیل الکترولیتی CO 2 حاصل از کربنات ها و بی کربنات های اقیانوس به محصولات کم کربن از جمله CO استفاده می کنند. لی و همکاران، 2019 ؛ لیز و همکاران، 2020 ) و فرمت (HCO 2- . ) ( لی و همکاران، 2020 ) با الکترودهای مسی، مجموعه وسیعی از محصولات احیا، از جمله محصولات حاوی کربن بزرگتر مانند اتانول، پروپانول و استات یافت می شود ( Digdaya et al., 2020 ). این ترکیبات آلی به عنوان سوخت یا مواد اولیه شیمیایی می توانند در اقتصاد کربن جدید نقش داشته باشند.
تبدیل کربن موجود در زیست توده دریایی به مواد شیمیایی، سوخت و مواد
در طی چندین سال گذشته، حرکت رو به رشدی برای استفاده از جلبکها، ریزجلبکها و زیست توده جلبک دریایی برای تولید سوختهای زیستی وجود داشته است ( سایره، 2010 ؛ ژائو و سو، 2014 ). از جمله مزایای زیست توده می توان به راندمان بالای تولید، سطح زیر کشت موجود که با کاربری فعلی زمین رقابت نمی کند و توانایی جذب و تبدیل CO 2 و کربنات های محلول در محیط های آبی اشاره کرد. جلبکهای دریایی که کاربردهای بیشماری دارند و در مقیاسهای بزرگ کشت میشوند، میتوانند هفت برابر کربن دیاکسید زیست توده لیگنوسلولزی زمینی (عادی نشده) را جدا کنند ( ژانگ و همکاران، 2020 ). این نوع زیست توده آب های دریایی و نمکی دارای پمپ های بی کربنات فعال هستند که می توانند بی کربنات ها را با کربنیک انیدرازها تغلیظ و خشک کنند. CO 2 جذب شده در این فرآیند بیولوژیکی سپس از طریق فتوسنتز به قند تبدیل می شود. نیاز به کشت و برداشت کارآمد زیست توده دریایی در اقیانوس های باز منجر به نوآوری در سیستم های رباتیک خودکار شده است ( Zereik et al., 2018 ). سیستم های تبدیل زیست توده فراساحلی نیز در نظر گرفته شده است ( نصار و همکاران، 2020 ).
زیست توده دریایی را می توان به سوخت های مایع پر انرژی یا مواد شیمیایی تبدیل کرد که می توانند مستقیماً در اقتصاد کربن فعلی استفاده شوند. تعدادی از فن آوری های تبدیل زیست توده از جمله هضم بی هوازی، تبدیل به گاز و تجزیه در اثر حرارت وجود دارد. در مقایسه با زیست توده زمینی، محتوای آب و نمک زیست توده دریایی به طور قابل توجهی بالاتر است، و بنابراین، مسیرهای تبدیل آنها محدود است. بنابراین، فناوریهای نوآورانهای که میتوانند مستقیماً با بیومس مرطوب و شور مانند جلبک دریایی کار کنند، مورد نظر هستند.
اخیرا، ما یک رویکرد منحصر به فرد را نشان داده ایم که جلبک دریایی را به هیدروژن زیستی تبدیل می کند ( ژانگ و همکاران، 2020 ). تیمار حرارتی قلیایی ما (ATT) جلبک دریایی قهوهای و مرطوب با NaOH و کاتالیزور Ni/ZrO2، هیدروژن زیستی تولید میکند، در حالی که تشکیل COx را در دماهای متوسط (<500 درجه سانتی گراد) تحت فشار محیط سرکوب میکند . مشتق شده زیستی استفاده می کنیم در این فرآیند، ما از انرژی خورشیدی ذخیره شده در زیست توده دریایی برای تولید H 2 ، در حالی که کربن و مواد مغذی (مانند N، P و غیره) به عنوان گونه های محلول به اقیانوس باز می گردند. این طرح واکنش ابتکاری هیدروژن مشتق شده زیستی را تولید می کند، در حالی که زیست توده دریایی به کربنات های جامد تبدیل می شود، همانطور که در شکل 4 نشان داده شده است . با استفاده از Ca(OH) 2 مشتق شده از ضایعات قلیایی صنعتی مانند سرباره آهن و فولاد و خاکستر بادی به جای سنگ آهک تازه استخراج شده (CaCO 3 )، واکنش ATT را می توان با کاهش نیاز کلی انرژی انجام داد، در حالی که زباله های جامد را تصفیه کرد و آنها را به حداقل رساند. الزامات دفن زباله یک معادله خالص در معادله نشان داده شده است. 9 . ادغام دو حلقه واکنش شیمیایی، عملیات حرارتی قلیایی زیست توده دریایی و کانیسازی کربن، مسیر جدیدی را به سمت تولید انرژی زیستی انتشار منفی میدهد، زیرا کربن حاصل از زیست توده دریایی را میتوان به عنوان بیکربنات در اقیانوس جدا کرد. سایر فناوریهایی که کارایی اتم کربن را به حداکثر میرسانند و ذخیرهسازی طولانیمدت کربن را فراهم میکنند باید مورد بررسی قرار گیرند. این مسیرهای جدید ممکن است نه تنها برای تولید مواد شیمیایی و مواد موجود، بلکه برای تولید مواد شیمیایی و مواد جدید از طریق فناوریهای نوآورانه بسیار یکپارچه مفید باشند.
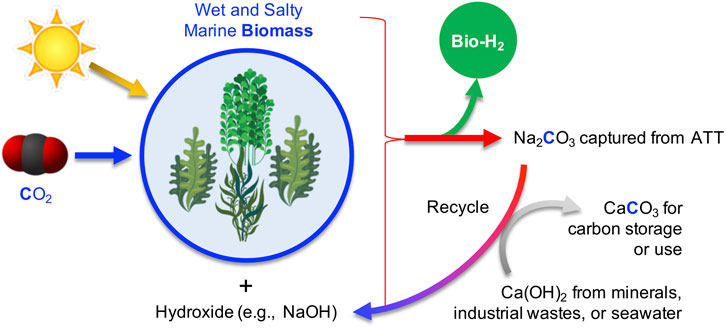 شکل 4 . پیش تصفیه حرارتی قلیایی (ATT) زیست توده دریایی برای ترسیب کربن.
شکل 4 . پیش تصفیه حرارتی قلیایی (ATT) زیست توده دریایی برای ترسیب کربن.
یک حوزه نوظهور مهم که میتواند مستقیماً با فناوری ATT مرتبط باشد، بازیابی عناصر مهم استراتژیک است که غلظت رقیق در اقیانوس یا زیست توده دریایی یافت میشوند. در حالی که غلظت مطلق بسیاری از عناصر کمیاب زمین (REEs) موجود در آب دریا اغلب بسیار کم است (31.8-168 pmol L -1 موجود در اقیانوس آرام غربی) ( Deng et al., 2017 )، آن غلظت REE موجود در زیست توده، مانند جلبک دریایی می تواند به طور قابل توجهی بالاتر باشد. این محتویات REE برای La و Ce بالاتر است، اما میتوان آن را از 1 تا 100 نانوگرم در گرم در انواع جلبکهای دریایی یافت. علاوه بر این، غلظت عناصر REE در خاکستر به دست آمده از جلبک دریایی به طور قابل توجهی بالاتر است، به طوری که غلظت La و Ce می تواند به بالای 100 نانوگرم گرم در 1 برسد ( Fu et al., 2002 ; Piarulli et al., 2021 ). در واکنش ATT که در بالا ذکر شد، علاوه بر ذخیرهسازی خالص CO 2 به شکل کربناتها، بقایای بیوچار از زیست توده دریایی با عناصر REE غلیظ و سایر عناصر حیاتی در سطوحی مشابه جریانهای منابع غیرمتعارف (به عنوان مثال، زباله به انرژی تولید میکنیم). خاکستر یا سرباره فولاد/آهن). یک مسیر جالب آینده، ادغام تولید ATT H 2 و ذخیره CO 2 با مراحل شستشو و جداسازی پایین دست برای بازیابی عناصر کمیاب زمین مانند Ce یا La از این مواد.
همانطور که در بالا نشان داده شد، H2 را می توان از طریق ابزارهای الکتروشیمیایی از آب دریا نیز تولید کرد (به بخش ضبط و تبدیل پشت سر هم مراجعه کنید). تولید کنند، نویدبخش هستند رویکردهای الکتروشیمیایی نیز به عنوان NET هایی که می توانند H2 ( راو و بیرد، 2018 ؛ راو و همکاران، 2018 ). این سوال که در نهایت کدام فرآیند تاثیر بیشتری بر غلظت CO 2 خواهد داشت هنوز مشخص نیست و واضح است که هر دو فناوری ارزش پیگیری را دارند. ما معتقدیم که استراتژی ATT که در اینجا نشان داده شده است، نویدبخش است. می توان از متمرکز کننده های خورشیدی برای گرم کردن واکنش ها استفاده کرد، که به دمای نسبتاً متوسطی متکی هستند. علاوه بر این، ما نه تنها پتانسیل تولید H2 با انتشار منفی ، بلکه تمرکز عناصر دارای اهمیت استراتژیک برای نوآوری های انرژی پاک آینده را نیز می بینیم.
اظهارات پایانی
جذب، تبدیل و ذخیره کربن اقیانوسی یک مسیر جایگزین فریبنده برای رسیدگی به تغییرات فوری آب و هوا در مقیاس ارائه می دهد. سطح فعلی جذب CO 2 مهندسی شده توسط اقیانوس، خارج از افزودن قلیایی و با استفاده از فرآیند اسیدی شدن الکتروشیمیایی، مورد بررسی قرار نگرفته است. بنابراین، تلاش قابل توجهی باید برای پرداختن به چالش ها و فرصت های حیاتی در این زمینه و در عین حال ایجاد محیطی بهتر برای حیات دریایی و بازیابی تعادل کربن زمین اختصاص داده شود. با افزایش سریع انرژی های تجدیدپذیر مقرون به صرفه، ما اکنون فرصت های هم افزایی برای جذب، تبدیل و ذخیره کربن آلی و معدنی در اقیانوس و جایگزینی کربن مشتق شده از فسیل داریم. سیستمهای الکتروشیمیایی نوآورانه امکان واکنشهای پشت سر هم را میدهند که CO 2 حاصل از بیکربنات و کربناتها را به محصولات با ارزش افزوده (مانند CO و فرمت) تبدیل میکنند. در رویکردی دیگر، عملیات حرارتی قلیایی میتواند بیو هیدروژن تولید کند و کربن را در کربناتهای جامد ذخیره کند.
گنجاندن محیط در مرز سیستم راه حل های مهندسی شده اغلب پیامدهای نامطلوبی دارد، به ویژه هنگامی که در مقیاس های صنعتی بزرگ مستقر شوند. ممکن است جهش های محلی در pH اقیانوس ها وجود داشته باشد، افزایش قابل توجهی در غلظت فلزات که منجر به توده های جلبکی مضر و افزایش سمیت می شود. بنابراین، مهم است که تمام اثرات کوتاه مدت و بلندمدت زیست محیطی و اکولوژیکی هر راه حل مهندسی شده را قبل از اجرای آن در مقیاس بزرگ در نظر بگیرید. علاوه بر این، استقرار این راهحلهای مدیریت کربن مبتنی بر اقیانوس به توسعه فناوری نوآورانه سیستمها نیاز دارد. اینها شامل انتقال کارآمد مواد به سایت و راکتورهایی است که ممکن است مجبور باشند در حالت توزیع شده با انرژی تجدیدپذیر کار کنند. اتوماسیون و تشدید فرآیند برای چنین توسعه فناوری بسیار مهم است. استفاده از صنایع دریایی، مانند خطوط کشتیرانی کانتینری، برای دسترسی به مناطق وسیعی از اقیانوس برای استقرار فناوریهای CCUS (به عنوان مثال، قلیائیت اضافه شده) گزینههای هم افزایی بالقوه هستند. این راهحلهای CCUS مبتنی بر اقیانوس، نمونههای خوبی هستند از اینکه چگونه میتوانیم با اقیانوس برای توسعه اقتصاد کربن جدید کار کنیم و در عین حال سیارهای بهتر برای همه ایجاد کنیم.
بیانیه در دسترس بودن داده ها
مشارکت های اصلی ارائه شده در مطالعه در مقاله/مواد تکمیلی گنجانده شده است، سوالات بیشتر را می توان به نویسنده مربوطه هدایت کرد.
مشارکت های نویسنده
HV و AHP این دست نوشته را طراحی و نوشتند.
منابع مالی
این کار توسط کمک مالی موسسه ارزیابی و برنامه ریزی فناوری انرژی کره (KETEP) با بودجه دولت کره (MOTIE) (شماره 20188550000580) و NSF CBET 1927336 (AccelNet-SCO2RE) پشتیبانی شد.
تضاد منافع
نویسندگان اعلام می کنند که این تحقیق در غیاب هر گونه روابط تجاری یا مالی که می تواند به عنوان تضاد منافع بالقوه تعبیر شود، انجام شده است.
یادداشت ناشر
تمام ادعاهای بیان شده در این مقاله صرفاً متعلق به نویسندگان است و لزوماً ادعاهای سازمان های وابسته به آنها یا ناشر، ویراستاران و داوران را نشان نمی دهد. هر محصولی که ممکن است در این مقاله ارزیابی شود، یا ادعایی که ممکن است توسط سازنده آن باشد، توسط ناشر تضمین یا تایید نمی شود.
